Evolución de las extremidades de los vertebrados
Tras hablar de evolución convergente y evolución paralela, es turno de otro artículo en el que se habla de esta última, aunque mezclada (y, a mi parecer, confundida) con la convergencia (Figura 1). Esta vez vamos abordar el tema desde una perspectiva muy diferente, discutiendo las causas y mecanismos que llevan a dicha convergencia o paralelismo, en lugar de demostrar que se ha dado ese proceso.
El artículo a comentar se trata de la revisión de Joyce Pierettia; Andrew R. Gehrkea; Igor Schneider; Noritaka Adachi; Tetsuya Nakamura; & Neil H. Shubin (2015), Organogenesis in deep time: A problem in genomics, development, and paleontology. PNAS; 112, 16: 4871-4876. Aunque uno de los principales enfoques que ofrecen es sobre el futuro de los estudios paleontológicos y biológicos, vamos a centrarnos en el texto según una perspectiva diferente: la de los procesos evolutivos, aunque sin ignorar los elementos que hacen posible descubrirlos y analizarlos.
Figura 1: ¿Paralelas o convergentes? Estos problemas pueden ser tan confusos como engañoso un efecto óptico... Fuente: Gratistodo.
El artículo a comentar se trata de la revisión de Joyce Pierettia; Andrew R. Gehrkea; Igor Schneider; Noritaka Adachi; Tetsuya Nakamura; & Neil H. Shubin (2015), Organogenesis in deep time: A problem in genomics, development, and paleontology. PNAS; 112, 16: 4871-4876. Aunque uno de los principales enfoques que ofrecen es sobre el futuro de los estudios paleontológicos y biológicos, vamos a centrarnos en el texto según una perspectiva diferente: la de los procesos evolutivos, aunque sin ignorar los elementos que hacen posible descubrirlos y analizarlos.
Introducción:
En las últimas décadas se ha descubierto una gran cantidad de taxones nuevos que revelan estados de transición en la evolución de los tetrápodos. Estos descubrimientos vienen dados por la mejora en el conocimiento geológico, que permite hacer más efectivo el trabajo de campo, y las nuevas y más precisas técnicas de laboratorio que mejoran el estudio tanto de los nuevos fósiles, como de los pertenecientes a colecciones antiguas. Estos avances hacen que el descubrimiento de las bases de la innovación morfológica se encuentre en un momento crítico en su larga historia (Pierettia et al., 2015).
En el artículo de Pierettia et al., (2015), se insiste en la utilidad de los fósiles para comprender la evolución morfológica, sin dejar de lado otras disciplinas. Los estudios basados en el genoma, la embriología y el desarrollo de los organismos no podrían predecir todas las formas extintas que nos revela la paleontología, pero son una gran ayuda para comprender los mecanismos y procesos que provocan estos cambios, las causas subyacentes a diferentes adaptaciones. Se ponen como ejemplo las evidencias fósiles de la existencia de reptiles similares a los mamíferos, que permiten interpretar correctamente las semejanzas fisiológicas y morfológicas entre aves y mamíferos como ejemplos de evolución paralela en lugar de como homologías. El amplio set de herramientas que nos proporcionan diferentes ramas científicas proporciona un nuevo marco de trabajo para probar hipótesis derivadas de descubrimientos paleontológicos, formando de este modo un programa de investigación interdisciplinar (Pierettia et al., 2015).
En el artículo se hace una recopilación sobre las explicaciones e hipótesis que rodean tres temas: el origen de los apéndices emparejados o por pares, la transición de aletas a extremidades con muñeca y dedos y la diversificación de estas extremidades. Si bien los tres temas son muy interesantes y recomiendo su lectura a quienes les interese el tema, solo en el primero y el último se habla de las cuestiones evolutivas que estoy tratando en las entradas del blog, por lo que solo desarrollaré esos dos apartados.
Origen de los apéndices emparejados
El desarrollo de apéndices organizados en parejas es uno de los eventos críticos en la historia de los vertebrados (Pierettia et al., 2015). Hay dos hipótesis sobre su origen que datan del siglo XIX: la del arco branquial (Figura 2), según la cual el último arco branquial, el posterior, se considera un precursor del cinturón pectoral y las aletas emparejadas (Gegenbaur, 1878), y la hipótesis del pliegue de las aletas, que sostiene que las aletas por pares derivan de pliegues laterales y longitudinales que aparecen pronto en el desarrollo y la evolución (Balfour, 1881; Mivart, 1879; Thacher, 1877).
Ambas hipótesis fueron propuestas originalmente a partir de observaciones de embriología y anatomía comparativas en tiburones actuales. Sin embargo, a partir de nuevos fósiles y datos moleculares de gran variedad de especies, se ha determinado que probablemente haya una tercera explicación para los orígenes de las aletas emparejadas (Pierettia et al., 2015).
(Pierettia et al., 2015) explican las evidencias que apoyan estas hipótesis, a la vez que las que las socavan y les restan fuerza. La primera de ellas tiene en su contra a los fósiles de bastantes especies extintas, por ejemplo. La hipótesis de los pliegues, en cambio, en principio parecía respaldada por el registro fósil, pues algunos agnatos extintos presentan pliegues en las aletas ventrolaterales. Sin embargo, estos pliegues están distribuidos de forma irregular en el árbol filogenético y se han interpretado como un resultado de la evolución convergente (Coates, 2003; Janvier, 2007; Sanson, 2010), porque además carecen de las estructuras que si poseen los apéndices en pares.
Una reevaluación de los fósiles de gnatostomados proporciona un escenario alternativo para el origen de este tipo de aletas (Figura 3). Los placodermos, el grupo hermano de los gnatostomados, poseen aletas pectorales y pélvicas similares a las de los peces modernos, y sus parientes más cercanos, los osteostracanos y los pitiuriápsidos, tienen aletas pectorales similares a las de esos placodermos, pero carecen de pliegues en las aletas (Janvier, 1996; Janvier, 2007). Esto sugiere que la condición primitiva de los gnatostomados es una pareja de aletas pectorales, lo que contrasta con la hipótesis original del pliegue de las aletas (Pierettia et al., 2015).
Figura 3: (A) Esquema de la hipótesis del pliegue de las aletas. (B): Características genéticas compartidas de los arcos branquiales y las aletas emparejadas y la medias en un embrión genérico de un gnatóstomo. (C): Un árbol filogenético de los primeros vertebrados. Los taxones asociados a una ilustración están en negrita. Fuente: Pierettia et al. (2015).
Pese a todo, los detalles sobre el origen de las aletas en pares siguen indeterminados, por lo que habrá que continuar las investigaciones tanto paleontológicas como genéticas para profundizar en esta cuestión.
Diversificación de las extremidades:
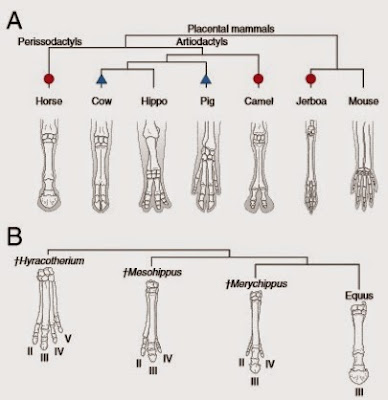
Aunque las extremidades de los tetrápodos son frecuentemente descritas como pentadáctilas, la realidad es que, cuando uno considera tanto el registro fósil como la variación de los taxones existentes en un contexto filogenético, el apéndice con cinco dedos no es ni primitivo, ni fijo (Figura 4). Los tetrápodos basales del Devónico tienen apéndices con seis o más dedos, como los plesiosaurios (Coates & Clack, 1990; Richardson & Chipman, 2003). De hecho, entre los apéndices de organismos fósiles y existentes, hay una gran variación de número digital, con patrones de reducción de las extremidades dándose de forma independiente en Lissamphibia, Squamata, Mammalia y Archosauria. Como norma, sin embargo, los tetrápodos actuales no tienen más de cinco dedos por extremidad, pese al hecho de que los fenotipos mutantes con polidactilia son comunes en muchos taxones, incluidos los humanos (Pierettia et al., 2015).
Figura 4: Diversificación evolutiva de las extremidades. (A): Filogenia de taxones de mamíferos mostrando grupos que han perdido dedos de forma independiente a través de distintos mecanismos: apoptosis (círculo rojo) y una expresión reducida de Ptch1 (triángulo azul). (B): Especímenes de equinos fósiles que documentan variaciones desde un estado con cinco dedos. Fuente: Pierettia et al. (2015).
La misión de los estudios sobre el tema ha sido buscar las regularidades y mecanismos que se encuentran detrás del proceso de reducción. Entre los vertebrados, la pérdida de dedos periféricos antes de los centrales es una secuencia común descrita por la ley de Morse (Morse, 1872), según la cual los dedos I y V son los más sencillos de perder. Los anfibios urodelos son el único taxón que ignora mayoritariamente esta norma, pues las especies de salamandra pierden los dedos V y IV secuencialmente.
Dos clases generales de cambios en el desarrollo pueden explicar la pérdida o reducción de los dedos. Una de ellas es un cambio en la especificación del primordio digital (la agrupación celular a partir de la cual se forma un determinado tejido o miembro en el desarrollo embrionario) durante el desarrollo temprano de la extremidad, lo que hace que se desarrollen menos dedos. El otro camino que puede llevar a esta pérdida es una modificación posterior del estado primario con cinco dedos, a través de la muerte programada de las células, conocida como apoptosis (Pierettia et al., 2015).
Los experimentos clásicos de Alberch y Gale buscaban explorar los mecanismos de la pérdida de dedos en taxones específicos usando anuros y urodelos como ejemplos. La pérdida de dedos en estos taxones aparece sin relación con la muerte celular, pero dependiente del número de células en el nacimiento de la extremidad: inhibidores de la mitosis provocaron los patrones de reducción específicos de estos taxones (Alberch & Gale, 1983; Alberch & Gale, 1985). Análisis más recientes en urodelos han extendido estos resultados, mostrando que la duración de la expresión de la proteína Shh (Sonic hedgehog... Sí, no es ninguna broma, se llama así) está correlacionada con el número de dedos que se forman al final (Stopper & Wagner, 2007). Una relación similar entre la expresión de Sonic hedgehog y la pérdida de dedos fue descubierta en el orden Squamata (Shapiro et al., 2003). Estos datos revelan un posible patrón de evolución "paralela" en los lissanfibios y los amniotas: una relación entre la pérdida de dedos y los cambios en la duración de la actividad de Shh (Harfe, et al., 2004; Zhu et al., 2008).
La reducción de los dedos ha ocurrido más veces en los amniotas, muchas veces como adaptación a la carrera y al salto. Estudios comparativos de perisodáctilos, artiodáctilos y roedores ofrecen más pistas sobre los factores genéticos envueltos en estas adaptaciones. El receptor de la proteína Shh, llamado Patched1 (Ptch1), se encuentra restringido en los bóvidos, que tienen muy reducidos los dedos, pero muy extendido en los ratones. Esto provoca que la señal de Shh esté atenuada en los bóvidos. Experimentalmente, además, se ha demostrado que una pérdida de este receptor es suficiente para que se produzca la fenocopia (copia del fenotipo de un organismo con un genotipo distinto) de algunos de los patrones de la extremidad del bóvido. En resumen: que el desarrollo de los cinco dedos depende del buen comportamiento del erizo azul más veloz de los videojuegos (Figura 5).
Figura 5: Sonic the Hedhehog, al que conoceréis por su clásica saga de videojuegos, por su serie de televisión, por el Smash Bros. y, ahora, por ser la inspiración del nombre de una de las proteínas que permiten que nuestros cinco dedos se desarrollen con normalidad. Fuente: Sonic wikia.
Al añadir más taxones al análisis, aparecen otros mecanismos para esa reducción. En los artiodáctilos basales, como el camello, Cooper et al. (2014) (Harfe, et al., 2004) descubrieron que la expresión de Ptch1 se encuentra inalterada en sus extremidades. En cambio, es la muerte programada de las células la que esculpe la muñeca y los dedos después de que su patrón se haya formado. También se ha investigado en las extremidades posteriores de un perisodáctilo, concretamente en el caballo (Equus),y en las extremidades posteriores de un roedor, el jerbo de pies peludos (Dipus sagitta, aunque en el texto viene citado con otro nombre en la mayor parte de las fuentes se le nombra de esta forma). En estas investigaciones se ha descubierto que la remodelación de la muñeca y los dedos en ambos casos era el resultado, de nuevo, de la apoptosis (Ferrari et al., 1998) (Figura 6).
Figura 6: Diferencias asociadas a la alteración de la morfología de la extremidad. La imagen superior y la central muestran la distribución del receptor Ptch1 en el ratón y la vaca, respectivamente, en diferentes momentos de la gestación. La inferior es un esquema de las células que sufren la apoptosis en la extremidad del caballo. Fuente: Pierettia et al. (2015).
Estos estudios muestran que la reducción de dedos a partir de la muerte celular parece haber evolucionado convergentemente en roedores (jerbo), perisodáctilos (caballo) y algunos artiodáctilos (camello) (Figura 4). Sin embargo, entre otros amniotas como el orden Squamata y artiodáctilos derivados como la vaca y el cerdo, son las alteraciones en la señal de la proteína Shh las que provocan cambios tempranos en la formación de la extremidad. (Pierettia et al., 2015)
La conclusión que puede extraerse de esto es que la evolución independiente de patrones comunes puede ser el resultado de la evolución paralela de diferentes tipos de modificaciones genéticas y del desarrollo en distintos taxones.
Conclusiones
Si bien el artículo de Pierettia et al., (2015) centra sus conclusiones en el futuro del estudio del registro fósil mediante las nuevas técnicas y la combinación de distintas disciplinas, nosotros vamos a centrarnos un poco más en las cuestiones evolutivas que estamos tratando en estas entradas.
En el apartado sobre el origen de los apéndices organizados por pares nos encontramos una situación similar a la de la primera entrada: la evolución convergente complicando el estudio de la filogenia y el origen de las distintas morfologías, haciendo parecer viables teorías y combinaciones que, una vez identificado este tipo de evolución, parecen poco probables.
En el segundo de los apartados, en cambio, se habla tanto de evolución paralela como de evolución convergente, cuando estos mecanismos son bastante diferentes. Recurramos de nuevo a las definiciones:
Evolución paralela: desarrollo evolutivo similar que se produce en linajes de un ancestro común. Así, los descendientes son tan parecidos como fueron sus ancestros (Diccionario de las ciencias de la Tierra).
Evolución convergente: desarrollo de una morfología similar en organismos que no están directamente relacionados debido a la adaptación a condiciones ambientales similares (Diccionario de las ciencias de la Tierra).
En este caso, se trata del desarrollo de una morfología similar (reducción de dedos) en distintos tetrápodos. Estos organismos están relacionados entre sí, es cierto, pero depende de a la escala a la que se mire, pues por ejemplo, el jerbo de pies peludos se encuentra más próximo a otros roedores que sí poseen cinco dedos que al caballo, pese a que ambos pierden los dedos por un mecanismo similar. La vaca y el cerdo también son más cercanos a mamíferos con cinco dedos que a los escamosos (Squamata). Sin duda en estos casos no se cumple la parte de la definición de evolución paralela que dice que los organismos son tan parecidos como fueron sus ancestros, puesto que, en lo referido a la morfología que estamos tratando (el número de dedos), se parecen más entre sí que a sus ancestros.
Por lo tanto, creo que podemos concluir que pese a lo que dice el artículo, en algunos de sus ejemplos no se trata exactamente de evolución paralela, sino más bien de otro caso de evolución convergente.
Finalmente, añadir un agradecimiento a Sonic hedgehog por permitir desarrollarse sin problemas mis cinco dedos, sin los cuales habría sido bastante más tedioso escribir este artículo. Aunque, viendo cómo va su saga últimamente, puede que empiecen a aumentar los casos de hipodactilia... (Figura 7).
Finalmente, añadir un agradecimiento a Sonic hedgehog por permitir desarrollarse sin problemas mis cinco dedos, sin los cuales habría sido bastante más tedioso escribir este artículo. Aunque, viendo cómo va su saga últimamente, puede que empiecen a aumentar los casos de hipodactilia... (Figura 7).
Figura 7: Esperemos que nuestros dedos no decaigan como la calidad de la saga del erizo azul... No queremos un "Boom" digital. Fuente: Booster.
Referencias bibliográficas
- Alberch, P.; Gale, E. A., 1983. Size dependence during the development of the amphibian foot. Colchicine-induced digital loss and reduction. Journal of Embryology and Experimental Morphology 76: 177–197.
- Alberch, P.; Gale, E. A., 1985. A developmental analysis of an evolutionary trend: Digital reduction in amphibians. Evolution 39 (1):8–23.
- Balfour, M. F., 1881. On the development of the skeleton of the paired fins of Elasmobranchii, considered in relation to its bearings on the nature of the limbs of the vertebrata. Proceedings of the Zoological Society of London, 1881:656–671.
- Coates, M. I., 2003. The evolution of paired fins. Theory Biosciences 122: 266–287.
- Coates, M. I.; & Clack, J. A., 1990. Polydactyly in the earliest known tetrapod limbs. Nature 347: 66–69.
- Ferrari, D.; Lichttler, A. C.; Pan, Z. Z.; Dealy, C. N.; Upholt, W. B.; & Kocher, R. A., 1998. Ectopic expression of Msx-2 in posterior limb bud mesoderm impairs limb morphogenesis while inducing BMP-4 expression, inhibiting cell proliferation, and promoting apoptosis. Developmental Biology, 197(1):12–24.
- Gegenbaur, C., 1878. Elements of Comparative Anatomy. MacMillan and Co., London, 690pp.
- Harfe, B. D.; Scherz, P. J.; Nissim, S.; Tian, H.; McMahon, A. P.; & Tabin, C. J., 2004. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell, 118 (4): 517–528.
- Janvier, P., 1996. Early Vertebrates. Oxford Monographs on Geology and Geophysics, vol. 33. XIII + 393 pp.
- Janvier, P., 2007. Homologies and evolutionary transitions in early vertebrate history. In: Anderson, J. S., & Sues, H-D. (eds), Major Transitions in Vertebrate Evolution. Indiana University Press, Bloomington, pp 57 - 121.
- Mivart, S. G., 1879. Notes on the fins of elasmobranchs, with considerations on the nature and homologues of vertebrate limbs. Transactios of the Zoological Society of London 10 (10): 439–484.
- Morse, E. S., 1872. On the tarsus and carpus of birds. Annals of the Lyceum of Natural History of New York, 10: 141–158.
- Pierettia, J.; Gehrkea, A. R.; Schneider, I.; Adachi, N.; Nakamura, T.; & Shubin, N. H., 2015. Organogenesis in deep time: A problem in genomics, development, and paleontology. PNAS; 112, 16: 4871-4876.
- Richardson, M. K.; Chipman, A. D., 2003. Developmental constraints in a comparative framework: A test case using variations in phalanx number during amniote evolution. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 296 (1): 8–22.
- Sansom, R. S.; Freedman, K.; Gabbott, S. E.; Aldridge, R. J.; & Purnell, M., A., 2010. Taphonomy and affinity of an enigmatic Silurian vertebrate, Jamoytius kerwoodi White. Palaeontology 53 (6): 1393–1409
- Shapiro, M. D.; Hanken, J.; & Rosenthal, N., 2003. Developmental basis of evolutionary digit loss in the Australian lizard Hemiergis. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 297 (1): 48–56.
- Stopper, G. F.; Wagner, G. P., 2007. Inhibition of Sonic hedgehog signaling leads to posterior digit loss in Ambystoma mexicanum: Parallels to natural digit reduction in urodeles. Developmental Dynamics 236 (1): 321–331.
- Thacher, J. K., 1877. Median and paired fins, a contribution to the history of the vertebrate limbs. Transaction of the Connecticut Academy of Arts and Science, 3:281–310.
- Zhu, J.; Nakamura, E.; Nquyen, M. T.; Bao, X.; Akiyama, H.; & Mackem, S., 2008. Uncoupling Sonic hedgehog control of pattern and expansion of the developing limb bud. Developmental Cell, 14 (4): 624–632.
Referencias y fuentes de imágenes online







3 comentarios:
Siento el retraso en la publicación. Anoche estaba demasiado cansada como para revisarla y no quería publicar la entrada sin hacer una revisión de la misma... Menos mal que no lo hice porque si no más de un "taxón" hubiera sido un "tazón".
Además, tampoco contaba con las 3 horas de darle formato a las referencias. En muchas faltaban autores, en algún capítulo de un libro faltaba el nombre del propio capítulo...
Eso refleja la importancia de revisar los textos "finales" antes de su publicación definitiva.
Aún así, todavía se te han escapado algunos tazones por el camino, jejejeje...
Ya, lo vi haciendo la síntesis final y lo corregí. Es el problema al leer un texto que has escrito tú mismo, muchas erratas las pasas por alto al leer por encima. Entre que la z y la x están al lado, y que como "tazones" existe no lo detecta el autocorrector...
Publicar un comentario