Los Oviraptorosauria
son un grupo diverso de dinosaurios maniraptora,
conocidos por numerosos ejemplares bien conservados de Asia Central y América
del Norte. Caenagnathidae, una familia
predominantemente norteamericana de oviraptorosauria,
fueron siempre representados sólo por el material fragmentario, y siguen siendo
poco conocidos. También tienen una larga y controvertida historia taxonómica.
Chirostenotes pergracilis
fue nombrado por Gilmore (1924) sobre la base de dos manos articuladas (CMN
2367) encontradas en la Formación Belly River de Alberta, Canadá. Aunque su
clasificación era incierta al principio, Osborn (1924) observó inmediatamente similitudes
entre ella y Oviraptor philoceratops,
que él creía que era un terópodo
similar a ornitomímidos.
C.M. Sternberg (1932, 1934) y Parks (1933) describen restos postcraneanos
adicionales de Macrophalangia canadensis
y Ornithomimus elegans,
respectivamente. Ornithomimus elegans
fue rebautizado más tarde como Elmisaurus elegans
(Currie 1989) sobre la base de similitudes con Elmisaurus rarus.
Tanto
Elmisaurus elegans
como Macrophalangia canadensis
fueron posteriormente sinonimizados con Chirostenotes pergracilis
(Currie y Russell 1988; Sues 1997) que es la especie tipo de Chirostenotes.
Caenagnathus collinsi
fue nombrado por R. M. Sternberg en 1940 basándose en una mandíbula casi
completa (CMN 8776) y ha sido objeto de debate. Sternberg (1940) y Cracraft
(1971) creían que es la mandíbula de un representante de un nuevo orden de las
aves, pero el trabajo de Osmólska (1976) demostró de forma concluyente que pertenecía
a un oviraptorosauria.
Esta mandíbula no ha dejado de ser taxonómicamente problemática, y puede ser un
sinónimo subjetivo menor de Chirostenotes pergracilis
(Sues 1997), u otro taxón (Currie 2005; Longrich et al. 2013). En 2001, una
nueva muestra de Caenagnathidae (TMP 2001.12.12)
se encontró en el Campaniano tardío de la Formación Dinosaur Park, en el
Dinosaur Provincial Park, Alberta, Canadá. Es la segunda mandíbula más completa
conocida en Alberta hasta la fecha. Se le ha asignado a cualquiera de Caenagnathus
(Currie 2005) o Chirostenotes
(Longrich et al. 2013).
Material de Caenagnathidae de
América del Norte se ha asignado indistintamente a siete géneros: Caenagnathus,
Chirostenotes,
Elmisaurus,
Hagryphus,
Leptorhynchos,
Macrophalangia,
y ornitomímidos
(incorrectamente). En 1997, Sues reasignó materiales de Caenagnathus collinsi
(CMN 8776) para Chirostenotes pergracilis,
y sugirió una especie separada, Chirostenotes elegans,
por Elmisaurus
elegans y CMN 2690 (Caenagnathus sternbergi
de Cracraft 1971). La revisión taxonómica más reciente (Longrich et al. 2013)
reconoce cuatro géneros, Macrophalangia
y ornitomímidos
sinónimos de Leptorhynchos
y Caenagnathus,
respectivamente, y estos sinónimos a su vez de Chirostenotes y Hagryphus.
Además, Longrich et al. (2013) ha asignado gran material de Caenagnathus
sternbergi a Chirostenotes
pergracilis y ha mantenido CMN 8776
como Caenagnathus
collinsi. El material de Caenagnathus
sternbergi, por lo tanto, se ha
asignado previamente a su propio taxón (Cracraft 1971; Currie 2005), Chirostenotes
elegans (Sues 1997), y Chirostenotes
pergracilis (Longrich et al 2013.).
Comparaciones de TMP 2001.12.12 con Caenagnathus
sternbergi (CMN 2690, TMP 1990.56.6, TMP 1992.36.390) muestra que son similares en morfología, y que
probablemente representan el mismo taxón (Currie 2005), lo que es problemático
para la remisión de esta muestra. Aunque la remisión de TMP 2001.12.12 probablemente
cambiará a medida que se describen nuevos ejemplares.
Por lo tanto, para facilitar la comprensión, el
artículo “Funston,
G. F. & Currie, P. J. (2014). A previously undescribed caenagnathid mandible from the late Campanian of Alberta, and insights into the diet of Chirostenotes pergracilis (Dinosauria: Oviraptorosauria)” en el que está basado
esta entrada, utilizará los criterios más recientes, específicamente los de
Longrich et al. (2013), lo que sugiere que TMP 2001.12.12 pertenece a Chirostenotes pergracilis,
aceptando que es probable que esto cambie en el futuro.
Independientemente de la nomenclatura, parece que
hay dos morfotipos entre mandíbulas Caenagnathidae de Alberta (Currie y Russell 1988): superficial de
pico (CMN 8776), y profundidad de pico (TMP
1990.56.6, TMP 1992.36.390, TMP 2001.12.12). TMP
2001.12.12 es el espécimen más completo de una mandíbula Caenagnathidae de profundidad de pico, y se habla de
ella en este artículo para entender la dieta de todo el grupo.
Abreviaciones institucionales:
CMN: Museo Canadiense de la Naturaleza, Ottawa, Ontario,
Canadá; TMP: Royal Tyrrell Museum de Paleontología, Drumheller, Alberta,
Canadá.
Paleontología sistemática:
Dinosauria Owen, 1842
Saurischia Seeley, 1888
Theropoda Marsh, 1881
Coelurosauria
Huene, 1914
Maniraptora
Gauthier, 1986
Oviraptorosauria
Barsbold, 1976
Caenagnathidae R.M. Sternberg,
1940
Caenagnathidae R.M. Sternberg,
1940
Holotipo: CMN 2367, manos izquierda y derecha.
Material al que hace referencia: CMN 2690, articular y surangular parciales; TMP 1979.20.1, esqueleto parcial; TMP 1990.56.6, dentario; TMP 2001.12.12, mandíbula.
Material al que hace referencia: CMN 2690, articular y surangular parciales; TMP 1979.20.1, esqueleto parcial; TMP 1990.56.6, dentario; TMP 2001.12.12, mandíbula.
Horizonte y localidad: Campaniano Superior de la Formación
Dinosaur Park.
Todas las muestras se encuentran dentro de Dinosaur Provincial Park, Alberta, Canadá.
Todas las muestras se encuentran dentro de Dinosaur Provincial Park, Alberta, Canadá.
Descripción: La mandíbula (TMP 2001.12.12) se
recuperó el 5 de julio de 2001 de Bonebed BB048 (50 ° 49.045 min, 111 ° 34.918
min) en el Dinosaur Provincial Park, de William Spencer y el segundo autor. El
horizonte está en la base de una unidad de arenisca cross-bedded encima de un
mudstone overbank. El depósito probablemente representa un grieta splay, como
se sugiere para otras areniscas fosilíferas dentro de la Formación Dinosaur
Park (Eberth 1990).
La región de la sínfisis
del TMP 2001.12.12 (Fig. 1a) está completamente preservada, y ambas ramas
mandibulares están al menos parcialmente conservadas. La rama izquierda es la
mejor preservada pero tiene algunos daños en el margen ventral. El angular está
casi completo en el lado izquierdo, pero estaba rota y se ha dejado en la
posición en la que se encontró. EL angular no está presente en el lado derecho
(Fig. 1c). El prearticular se conserva sólo como una pequeña oblea de hueso
medial al angular, y posiblemente una hoja de hueso que forma la superficie
medial del proceso retroarticular. En la descripción de Caenagnathus collinsi
por Sternberg (1940), que ilustra una sección transversal hipotética que
muestra la relación de la prearticular al angular, sobre la base de sus observaciones de CMN 8776, que tiene un prearticular. Su
ilustración muestra que el prearticular es similar a una placa, y se encuentra medial
al angular, a lo largo de toda su longitud. Sobre la base de sus ilustraciones
de CMN 8776, es probable que el prearticular no esté completamente conservado
en el TMP 2001.12.12, pero habría sido comparable a CMN 8776 en la vida. Aun
así, el prearticular de TMP 2001.12.12 no es lo suficientemente completo como
para proporcionar información útil (Fig. 2: ?pa). La región articular es completa
en el lado izquierdo, aunque alguna compresión parece haber distorsionado el
contacto del angular con el articular-surangular-coronoides (ASC) complejo
(Fig. 3a). El proceso retroarticular izquierdo está intacto. Caenagnathidae se caracterizan por una fusión del articular,
surangular,
y coronoides, denominado articular-surangular-coronoides (ASC) complejo (Currie
et al. 1993). En el lado derecho, la parte dorsal del ASC complejo se conserva,
pero no la superficie ventral de la región articular. Esto incluye la cresta
media y la porción medial de la cavidad glenoidea, pero poco de la porción
lateral de la cavidad glenoidea. Parece que la splenial
está totalmente ausente, salvo por una pequeña
sutura posterior para el origen del músculo
geniogloso que es evidencia de fusión (Fig. 2b).
En general, la mandíbula es larga, estrecha y baja
(Figs. 1b, 3, Tablas 1, 2), a diferencia de la mayoría de oviraptorosauria,
pero se conserva la gran ventana externo mandibular típica de oviraptorosauria.
La mandíbula es de 188mm de largo, y las ramas se inclinan lateralmente,
alcanzando una anchura transversal máxima de 73,8 mm (Tabla 2: 11) y que
convergen de nuevo hacia la región articular.
 |
|
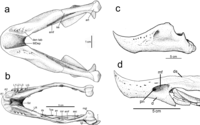
Figura 1. Chirostenotes
pergracilis, TMP 2001.12.12: (a) vista dorsal; (b) vista lateral izquierda;
(c) vista lateral derecha; (d) vista ventral.
|
Dentario: El dentario de TMP 2001.12.12 se compone
de una vista anterior, la porción en forma de pico, un estante de la sínfisis
robusta, y rami divergente posterior. El margen oclusal está vuelto hacia
arriba en sentido anterior, formando un borde afilado (fig. 3). La superficie
anterolabial del dentario es subvertical. En cara lateral, el pico aparece
cóncavo, porque la línea media del borde oclusal se extiende más dorsalmente
que los bordes laterales (Figs. 1b, 3). La sínfisis
mandibular se fusiona, sin evidencia de separación de la sutura (Figs. 1a, 1d,
2a). Anterior y medial a la ranura Meckelian (fig. 2b), hay un ligero surco en
su superficie ventral. El pico del dentario aumenta de grosor ventralmente
hasta su cruce con la plataforma de la sínfisis.
La superficie ventral del margen produce una "barbilla" distinta, con
el ápice anterior a las ranuras Meckelian. Esta barbilla está marcada por un
origen en forma de corazón para el músculo
geniogloso (Fig. 2b: gen). En las partes más anterolateral del
origen del músculo
geniogloso hay un agujero. Esta zona de origen muscular es a
diferencia de otras de los de otros especímenes de Caenagnathus,
que son en forma de reloj de arena (Currie et al. 1993). La superficie labial
del dentario está marcada por tres filas de agujeros anteroposteriores (fig.
1b, 2b, 3). De éstos, el superior es el más largo y tiene la mayor cantidad de
aperturas, con al menos 10 agujeros. Es 5 mm desde el margen oclusal, y
paralela a ella. Esta fila de agujeros se extiende desde la línea media de la
fosa mandibular y cada agujero se abre dorsal y labialmente. El agujero más
anterior de la fila superior es el más grande, y Currie et al. (1993) señalaron
que probablemente representan una salida para una rama del nervio dentario
inferior y los vasos sanguíneos asociados. La fila intermedia se compone de al
menos dos pequeños agujeros, no vistos en otras muestras que poseen sólo dos
filas de aberturas. Parece que los agujeros en TMP 2001.12.12 son asimétricos,
debido a que tres pequeños agujeros están presentes en el lado derecho (Fig.
1c), y dos a la izquierda (fig. 1b). Sin embargo, la rotura en el lado derecho
oscurece las posiciones de los otros agujeros, por lo que es imposible para
determinar el grado de asimetría en esta muestra. Si la fila del medio de
agujeros está presente en ambos lados, lo que es único entre Caenagnathidae, pero parece que la posición del
agujero es variable individualmente. La fila inferior comprende ocho agujeros,
cada uno más pequeño en tamaño que los de la fila superior, pero igual en
tamaño a los de la fila intermedia (Figs. 1b, 3). Estos agujeros siguen al
margen ventral del dentario, y se extienden desde la línea media a 10 mm por
delante del punto con la fosa mandibular. El trabajo de Currie et al. (1993)
indicó neumatización
del dentario en CMN 8776, y esto se confirma en TMP 2001.12.12. La rotura en el
lado derecho revela una cámara de paredes lisas, anterior a la fosa mandibular
rota (Fig. 1c). La medida de la cámara está oscurecida por la matriz, pero
parece extenderse casi hasta la línea media. Imágenes de tomografía
computarizada (CT) confirman la presencia de la neumatización
(Fig. 4). El dentario izquierdo conserva una depresión en la superficie lateral
de la mandíbula (fosa mandibular). Hay una pneumatopore dentro del margen
anterior de la fosa mandibular (fig. 3). En 8776 CMN y TMP 1990.56.6, el pneumatopore
se encuentra fuera de la fosa mandibular. No está claro si esto es
taxonómicamente importante, o es el resultado de la variación individual. Las
ranuras Meckelian son medio-lateralmente estrechas pero profundas dorso-ventralmente,
y se extienden hacia la línea media de la mandíbula en la parte posterior y en
las superficies ventrales de los dentarios (Fig. 2b). No llegan a la sínfisis,
pero terminan en fosas profundas a 5 mm de la línea media. Dentro de estos
pozos hay agujeros que conectan las ranuras al interior de la región de la sínfisis.
Si hay una cavidad continua a través de la línea media a causa de neumatización,
es razonable que estos agujeros se abran en esta cavidad.
La superficie lingual del dentario es complejo
(Figs. 1a, 2a). El estante de la sínfisis
tiene un surco profundo en la línea media (depresión de la sínfisis)
(Fig. 2a: Sd), que puede haber acomodado una lengua grande. La depresión de la sínfisis
se estrecha posteriormente hasta el margen posterior del dentario en la línea
media. Los bordes laterales de la depresión de la sínfisis
están marcados por ranuras longitudinales vasculares, con agujeros que se extienden
en el hueso en sus extremos anteriores (Fig. 2a: VG). La depresión de la sínfisis
y origen bien desarrollado del músculo
geniogloso pueden ser evidencia de una lengua de gran alcance
en Chirostenotes,
porque el músculo
geniogloso es el principal elemento saliente, lengua, en la
mayoría de los amniotas (Smith 1988). Esta lengua se pudo haber utilizado para
la recolección de alimentos o manipulación dentro de la boca.
La superficie anterolingual del margen oclusal es
superficialmente estriada, como en CMN 8776, TMP 1990.56.6 y TMP 1991.144.1.
Las acanaladuras en TMP 2001.12.12 se componen de una depresión en la línea
media, y una depresión a cada lado (Fig. 2a: A1, A2, respectivamente). Las
crestas que separan las depresiones se unen postero-ventralmente, pero no
tienen la rugosidad ventral descrita por Currie et al. (1993). Hay, sin
embargo, un pequeño (1 mm) tubérculo debajo de la convergencia de las crestas,
pero es muy distinto del tubérculo grande de CMN 8776, que está formado por las
crestas linguales.
Lateral a la depresión de la sínfisis,
crestas linguales se extienden subparalelas a la depresión de la sínfisis
pero divergen posteriormente (Figs. 1a, 2a). En el extremo anterior de cada una
de las crestas linguales, hay un tubérculo. Lateral a cada nervio lingual, una
ranura longitudinal es más ancha y más profunda en sentido anterior. Las
ranuras longitudinales están bordeadas lateralmente por el margen oclusal ranurado
del dentario, que tiene tres ranuras oclusales laterales por lado (Figs. 2A). Los
surcos oclusales laterales son más fuertes en sentido anterior, y cada uno se
extiende ventralmente en un pozo. Cada cresta oclusal lateral es rugosa. Las
crestas oclusales laterales son menos pronunciadas posteriormente, donde las
ranuras longitudinales se convierten en superficiales. Posterior a la tercera
arista oclusal lateral, el margen oclusal es recto y agudo. Posteriormente, la
rama de cada dentario se divide en una porción dorsal y ventral (fig. 3). La
porción dorsal en contacto con el ASC complejo y la porción ventral se
encuentra con el angular y, posiblemente, prearticular (Figs. 2A, 3). La unión
de las dos porciones se redondea, y forma el borde anterior de la ventana
mandibular. La porción dorsal está medio lateralmente bifurcada donde entra en
contacto el ASC complejo (Figs. 2A, 3). La brida medial de esta bifurcación es
más larga que en otras muestras, y está a más de la mitad de la longitud de la
brida lateral. Esto crea un contacto de doble bloqueo y permitiría solamente un
movimiento intramandibular limitado. Cuando la brida lateral de la porción
dorsal inserta en el ASC complejo, se forma una cresta dorsal. Esta
brida también se estrecha posteriormente, creando una sutura en forma de Z en
vista lateral (figuras 1b, 3).
La porción ventral de los insertos dentarios sobre
la superficie lateral del angular, y que contribuye al margen ventral de las ventanas
mandibulares externas (Fig. 3), se estrecha posteriormente, aunque su extensión
posterior es desconocida debido a la rotura.
Articular-surangular-coronoides complejo:
El ASC complejo está bien fusionado (figuras 1, 2a,
3) y no muestra ninguna evidencia de suturas, solo una cicatriz en la base del
cóndilo articular que es el remanente del contacto articular-surangular original
(fig. 2a). También puede haber una sutura coronoides, de la que se hablará más
adelante.
| MEDICIONES (mm) |
| ESPECIMEN | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CMN 8776 | 61.9 | 159 | 70.9 | 17.4 | 48 | 23 | 104 | 225e |
| TMP 1979.8.622 | >21 | - | >26 | >13 | 32e | 15 | - | - |
| TMP 1990.56.6 | 46.5 | 120 | 55 | 25 | 57e | 21 | 79.5 | - |
| TMP 1991.144.1 | 27.2 | - | 31.6 | >12.3 | 34.5 | 17e | - | - |
| TMP 1992.36.390 | 29.6 | - | 38.5 | 18.4 | 34 | 18 | 51.5 | - |
| TMP 1992.40.44 | 32 | - | 42.7 | 21.7 | - | - | - | - |
| TMP 2001.12.12 | 32.8 | 103.7 | 56 | 20.4 | 51.2 | 20.5 | 71.6 | 188 |
Tabla 1.
Mediciones comparables de mandíbulas caenagnathidae. 1, la longitud más corta de la sínfisis; 2, longitud total dentario; 3, la longitud de la sínfisis largo de la curva; 4, altura detrás de la sínfisis; 5, ancho detrás de la sínfisis; 6, la anchura entre Meckelian detrás de la sínfisis estante; 7, la longitud de sínfisis mandibular a ventana externa; 8, la longitud total de la mandíbula. Medidas orientativas indicadas por "e".
La dieta de Oviraptorosauria se ha estudiado
anteriormente, con varias conclusiones. Un estudio global por Zanno y Makovicky
(2011) encontró que Oviraptorosauria en general mostró
adaptaciones a la herbivoría, y utiliza CMN 8776 como representante de Caenagnathidae. Sin embargo, su
enfoque comparó caracteres entre coelurosauria y características que
por tanto, están compartidas por ese grupo, en lugar de los exclusivos para Caenagnathidae. Del mismo modo, Longrich et al. (2010)
concluyeron que oviraptoridae son herbívoros basados
en las proporciones de las extremidades anteriores y las comparaciones con dicinodontes, loros y tortugas, pero
no examinaron Caenagnathidae. En un artículo posterior, Longrich et al.
(2013) se refirió brevemente a Caenagnathidae, y llegó a conclusiones similares a las
Longrich et al. (2010). Cracraft (1971), también, señaló una similitud
convergente entre Caenagnathidae y dicinodontes, basándose sólo en CMN
8776, y una región articular aislada de CMN 2690. En contraste, Barsbold (1977,
1983) determinó que al menos algunos Oviraptorosauria tenían adaptaciones para durofágia, basado en Conchoraptor. Estudios recientes
realizados por Lu et al. (2013) demostraron mediante el uso de Yulong Mini y
otros especímenes que las proporciones de las extremidades posteriores no
cambian ontogenéticamente. Esta tendencia se observa con más frecuencia en los
herbívoros, y llevó a Lu et al. (2013) a creer que Oviraptorosauria no persiguen a sus
presas. Esto proporciona un soporte débil para la herbivoría. Sin embargo, como
Currie et al. (1993) observaron, Caenagnathidae derivan de los terópodos, que en su mayoría son
carnívoros, y muestran algunas adaptaciones poscraneales de herbivoría. De
hecho, sus garras curvadas son a diferencia de las rectas de ornitomímidos, e implican algún tipo
de función de agarre.
Mediciones comparables de mandíbulas caenagnathidae. 1, la longitud más corta de la sínfisis; 2, longitud total dentario; 3, la longitud de la sínfisis largo de la curva; 4, altura detrás de la sínfisis; 5, ancho detrás de la sínfisis; 6, la anchura entre Meckelian detrás de la sínfisis estante; 7, la longitud de sínfisis mandibular a ventana externa; 8, la longitud total de la mandíbula. Medidas orientativas indicadas por "e".
El surangular forma el margen dorsal de la ventana mandibular
externa (fig. 3), y en contacto con el angular, articulares, y posteriores
posiblemente prearticular a la ventana. Anteriormente, el surangular interdigita con el dentario. La brida ventral de la parte
anterior del surangular
excluye el dentario desde el margen dorsal de la ventana mandibular externa y
forma la superficie lateral de la rama de la mandíbula (fig. 3). La porción medial
del surangular
se encuentra entre las dos puntas del dentario, y parece extenderse justo
medial a la fosa mandibular. En caso de que se superpone a la ventana
mandibular externa, el surangular
es desviado lateralmente, produciendo un labio distinto de hueso por debajo de
una ranura poco profunda en la superficie lateral (fig. 1b).
El coronoides está completamente fusionado al surangular.
Hay, sin embargo, un posible remanente de una sutura, conservado como una
pequeña cresta sólo anteromedial a la rugosidad coronoides, y un pequeño canal
que se extiende en la superficie ventral del ASC por encima de la ventana
mandibular externa (fig. 2b). El proceso
coronoides se declina medialmente, pero no en el mismo grado
que el de CMN 8776. El coronoides es rugoso y está excavado dorsalmente, con
rugosidades en los bordes medio y lateral.
Posteriormente, el borde dorsal del surangular
se redondea, y ensancha medio-lateralmente donde se fusiona con el articular.
Puede haber evidencia de una sutura aquí, justo posterior a la flexión dorsal
del surangular
(Fig. 2a), pero también pueden haber sido causados por daños abrasionales a
la muestra.
El proceso articular se caracteriza por una cresta
longitudinal, convexa en cara lateral, con una curva más pronunciada
anteriormente y un descenso más plano detrás del ápice (Fig. 3). La porción
medial de la cavidad glenoidea de la apófisis articular es más grande que la
porción lateral, y es convexa tanto en vistas anteroposterior y medio-lateral
(fig. 3). Esto crea una plataforma, que se adelgaza hacia los
bordes. La superficie inferior de la porción medial de la cavidad glenoidea es
rugosa, y la superficie superior es porosa. La porción medial de la cavidad
glenoidea es más amplia inmediatamente detrás de su borde anterior, y luego se
estrecha posteriormente hasta que termina cerca de la parte posterior de la
cresta articular (Fig. 2a). El glenoideo lateral es mucho más estrecho que el
uno medial, y alcanza su máxima longitud media anchura. Posteriormente,
se une a la cresta articular para formar un tubérculo que cubre el proceso
retroarticular. Al igual que con la cavidad glenoidea medial, que es convexa en
cara lateral, pero medio-lateralmente forma una pendiente continua con la
cresta articular, que se estrecha a un borde lateral delgado (fig. 3).
El proceso retroarticular se compone del angular
ventralmente, del articular
lateralmente, y del prearticular, si está presente, medialmente. No hay sutura
por lo que está presente, pero una ranura longitudinal que se extiende la
longitud del proceso retroarticular puede separar el angular y prearticular
(fig. 2b). El proceso retroarticular tiene forma de hacha, con un borde
semicircular posterior.
Prearticular:
El prearticular puede o
no puede ser preservado en TMP 2001.12.12, pero estuvo sin duda presente en
vida. La mejor evidencia del prearticular es una hoja de hueso que forma el
proceso retroarticular medial, pero esto puede ser el angular (fig. 2b). Una pequeña oblea de hueso se encontró medial a
la angular en su extremo anterior (fig. 2a). Si este es el prearticular,
entonces se habría extendido como una placa delgada medial a la angular
(Sternberg 1940).| MEDICIONES (mm) | TMP 2001.12.12 |
| 9. Altura mínima del dentario | 20.9 |
| 10. Altura del margen anterior del dentario | 34.2 |
| 11. Ancho máximo en coronoides | 73.8 |
| 12. Altura máxima en coronoides | 44e |
| 13. Ancho entre los procesos coronoides | 57.6 |
| 14. Altura a la parte anterior de la ventana mandibular externa | 34.3 |
| 15. Duración de la ventana mandibular externa a lo largo del eje más largo | 58.6 |
| 16. Distancia entre glenoides mediales | 26.2 |
| 17. Distancia entre crestas articulares | 61.5 |
| 18. Ancho de la región articular | 81e |
| 19. Ancho del cóndilo articular | 27.7 |
| 20. Duración de la cresta articular anteroposterior | 24.7 |
| 21. Longitud anteroposterior del glenoideo medial | 17.2 |
| 22. Longitud anteroposterior del glenoideo lateral | 19.7 |
Tabla 2. Medidas de TMP 2001.12.12. Medidas
orientativas indicadas por "e".
Angular:
El angular es robusto posteriormente, pero se
adelgaza hacia delante. En su extremo anterior, que se encuentra medial tanto
al dentario como al surangular
(fig. 2a). Se forma la mayor parte del margen ventral de la ventana externa
mandibular (Figs. 1b, 3). Su extremo anterior tiene tres ranuras: una medial,
una dorsal y otra lateral. La ranura medial es para el prearticular, y se
extiende hasta el margen posterior de la ventana mandibular externa, donde se
combina con una cresta. La ranura lateral es para la inserción del dentario
(fig. 3), y se convierte ventralmente medida que se extiende y se estrecha
posteriormente. Se vuelve posteriormente superficial y se funde en una profunda
depresión ventral al proceso articular. El surco dorsal es poco profundo en su
extremo anterior, pero profundiza posteriormente. Se extiende sólo al margen
posterior de la ventana mandibular externa.
Posteriormente, el angular forma una depresión
subyacente a la apófisis articular y la parte lateral de la cavidad glenoidea
(fig. 3), como se describe por Currie et al. (1993). Una rotura oscurece el contacto
del angular con el ASC complejo, pero el angular parece girar desde una
posición medial anterior a una posición lateral posteriormente. Esto significa
que el angular y es probable que el prearticular formen el margen ventral de la
mandíbula, con un surco entre ellos (fig. 2b).
Paleobiología:
La mandíbula de TMP 2001.12.12 proporciona una
oportunidad única para poner a prueba la idea de que Chirostenotes pergracilis
fue al menos en parte herbívoro. Además de la osteología comparada, una
simulación por ordenador (Finite Element Analysis) probó cómo la mandíbula
reaccionó al estrés y la tensión, mientras comían (Fig. 5). Datos de la
tomografía computarizada se utilizaron para construir un modelo tridimensional
de la mandíbula en Mimics × 64 14.01. La posición del angular se corrigió en
Geomagic Studio 12 (64 bits) a la posición en vida y entonces el modelo fue
reflejado para reconstruir el lado derecho roto. El modelo se convirtió en una
malla de volumen con las propiedades físicas del hueso cortical en Strand 7.
Vectores de fuerza tirando de los coronoides simuló el aductor de la
musculatura de la mandíbula, y las restricciones colocadas en la región de la sínfisis
simulan un objeto de alimentos. Tres simulaciones se realizaron para probar las
capacidades estructurales de la mandíbula. Los resultados mostraron que el pico
y depresión de la sínfisis
son relativamente débiles, pero las crestas linguales están reforzadas (fig.
5).
La mandíbula hubiera estado cubierta en vida por una
rhamphotheca, que probablemente fue siguiendo de cerca la forma del dentario. En
las tortugas, la rhamphotheca sigue de cerca la superficie lingual del
dentario, pero el margen oclusal es dentado, en lugar de liso. No está claro si
Chirostenotes
seguiría este patrón, pero es razonable sugerir que la rhamphotheca de Chirostenotes
era bastante aguda. Esto habría proporcionado amplia superficie para el corte y
cizallamiento, pero debido a que el dentario es delgado, es poco probable que
fuera capaz de resistir una fuerza considerable, incluso con una cubierta
queratinosa (Figs. 5b, 5c). Los surcos oclusales laterales (Fig. 2a) se han
ocluido con el premaxilar y maxilar, por lo que habría sido eficaz en la
esquila de alimentos. El procesamiento de alimentos blandos, como carne, frutas
o vegetación frondosa estarían sin duda dentro de las capacidades de la
mandíbula. Los alimentos fibrosos pueden haber sido posibles, pero las plantas
leñosas probablemente habrían sido demasiado difíciles para Chirostenotes.
Currie et al. (1993) sugirieron que el número de surcos oclusales laterales y
dorsales aumenta ontogénicamente, sin embargo, TMP 2001.12.12 es 83% el tamaño
de CMN 8776 (Tabla 1), y muestra tres crestas menos por lado. Como TMP
2001.12.12 es un individuo más joven de un tamaño grande, es poco probable que
el número de crestas sea controlado ontogenéticamente. Las crestas linguales de
los dentarios habrían apoyado estructuras similares en la rhamphotheca
inferior, y si estos ocluidos con las características de la rhamphotheca
superior, habrían creado cantos afilados. La anatomía de los dentarios es
consistente con el movimiento de corte, que es eficaz tanto para carnívoros y
herbívoros. El contacto dentario-ASC estrechamente integrado (Figs. 2a, 3)
impediría kinesis lateral de la mandíbula, y limitaría la flexión dorso-ventral
de la articulación intramandibular. Del mismo modo, la fusión de los dentarios
impide la mandíbula tenga expansión lateralmente. Esto restringiría el tamaño
de los alimentos que Chirostenotes
era capaz de comer.
Cracraft (1971) observó similitudes funcionales de
la región articular de Caenagnathidae a dicinodontes,
pero en ese momento no eran conocidos mandíbulas Caenagnathidae profunda de pico. Un trabajo
considerable ha demostrado que dicinodontes
eran herbívoros, basado en adaptaciones del cráneo y postcráneo (Crompton y
Hotton 1967; Cluver 1971; Hotton 1986; Ray y Chinsamy 2003; Sullivan et al.
2003). King et al. (1989) estudiaron la evolución de los mecanismos de
alimentación en dicinodontes,
separándolas en basal, avanzado y formas superiores. Ellos muestran que cinco
características de la mandíbula dicinodonte,
emparejadas con numerosas características craneales, probablemente surgieron
como especializaciones para un mecanismo de esquila más eficiente. Las
características mandibulares son las siguientes: una ventana intramandibular;
una articulación de la mandíbula que permite el movimiento antero-posterior;
pérdida de la eminencia coronoides, junto con la expansión dorso-posterior del
dentario; fusión de los dentarios en la sínfisis;
y una pestaña lateral en el dentario de la musculatura de los aductores. De
estas cinco características, Chirostenotes
tiene cuatro, y sólo le falta una pestaña lateral en el dentario para anclar la
musculatura aductora expandida. King et al. (1989) explican estas
características como consecuencia de una reorganización de la musculatura de
los aductores. Estas adaptaciones mueven la musculatura aductora a una posición
más anterior y anclan un músculo pterigoideo alargado, que permite el
movimiento propalinal de la mandíbula. Este movimiento, combinado con la
anatomía de la mandíbula, produce acción de cizallamiento. King et al. (1989) relacionó
esto a la necesidad de procesar material vegetal de manera más eficiente. Si el
aparato de alimentación en dicinodontes
está realmente especializado para la herbivoría, la convergencia de estas
características en Chirostenotes
evidencia que la mandíbula de Chirostenotes
está adaptada para algún tipo de herbivoría.
En la comparación de Chirostenotes
con Diictodon
(Fig. 6a) se observa que un dicinodonte
con una mandíbula edéntula, muestra aún más similitudes entre los dos taxones.
Tanto Chirostenotes
y Diictodon
tienen articulaciones de la mandíbula dorsal convexa, con porciones medial y
lateral glenoideas y procesos retroarticulares bien desarrollados (Fig. 3). Propalinía
(movimiento antero-posterior de la mandíbula) ha sido demostrado en dicinodontes,
basado en las formas de sus articulaciones mandibulares (Crompton y Hotton
1967; King et al. 1989; Angielczyk 2004), por lo que es razonable suponer que Chirostenotes
era capaz de propalinía así, debido a que sus
articulaciones mandibulares son casi idénticas. Propalinía sería útil en un
mecanismo de corte de un herbívoro o carnívoro. La región de la sínfisis
de Diictodon
tiene un margen redondeado y un surco en la línea media (fig. 6a), como en Chirostenotes
(fig. 2a). En ambos taxones, el surco en la línea media puede ser evidencia de
una fuerte lengua, o puede mejorar la función de esquila de las mesas dentarias
y crestas linguales. La depresión de la sínfisis
del Diictodon
está delimitada lateralmente por mesas dentarias (Fig. 6a), que sirven como
bordes para cortar alimentos (Cluver 1971; Sullivan y Reisz 2005). Las crestas
linguales de Chirostenotes
están reforzadas estructuralmente (Fig. 5a), por lo que pueden haber funcionado
como las mesas dentarias en Diictodon.
Además, la mandíbula de Diictodon
es larga y baja, y también tiene una ventana mandibular externa (Fig. 6a). La
convergencia de morfología similar tanto en la región oclusal como en la región
articular de dicinodontes
y Caenagnathidae sugiere que las
mandíbulas se utilizan de la misma manera, como un mecanismo de corte
eficiente.
Aunque R. M. Sternberg (1940) y Cracraft (1971)
clasifican Caenagnathidae incorrectamente
como pájaros, Chirostenotes
comparte varias características con diversas aves. Psittacidae,
como Brotogeris chrysopterus,
el perico de alas doradas, también tiene una ventana mandibular externa y la
región de la sínfisis
es similar, aunque está vuelta hacia abajo desde el cuerpo de la mandíbula. Los
huesos postdentarios se funden, como en Chirostenotes,
pero el proceso
coronoides es más anterior en su posición en la mandíbula, y
no se declinan en sentido medial. La región articular de Brotogeris
difiere de la de Chirostenotes.
En lugar de ser convexa, con una cresta longitudinal en el centro, que es
cóncava, con un canal que se extiende en sentido anteroposterior. El proceso
retroarticular parece ser pequeño, si no ausente, y esto sugiere que las
articulaciones de la mandíbula de Chirostenotesy
Brotogeris tienen diferentes
restricciones al desplazamiento. R. M. Sternberg (1940) señala que la
articulación de la mandíbula de un pollo (Gallus gallus domesticus) es convexa
como en Caenagnathus collinsi,
que es sinónimo de Chirostenotes
pergracilis, como se ha mencionado
anteriormente. El proceso retroarticular de un pollo, sin embargo, se extiende
postero-dorsalmente, limitando el movimiento antero-posterior, en contraste con
el postero-ventralmente dirigido al proceso retroarticular de Caenagnathidae. Aunque el comportamiento de
trituración se ha sugerido para oviraptóridos
(Barsbold 1977, 1983), mandíbula de pico profundo Caenagnathidae probablemente
era incapaz de durofágia. Caenagnathus
(CMN 8776) muestra las adaptaciones que sugieren una dieta diferente a Chirostenotes,
pero estas diferencias no se van a discutir en este artículo. TMP
2001.12.12 carece de cualquier superficie plana para la trituración debido a la
depresión de la sínfisis
(Fig. 2a), y los huesos postdentarios están construidos a la ligera si una
fusión completa. Pneumatopores en la superficie lateral de la mandíbula, y una
tomografía computarizada (Fig. 4) confirman la presencia de neumatización
en la región de la sínfisis.
Esto aligera la mandíbula lo que la hace diferente de las mandíbulas robustas
vistas en la mayoría de durófagos. El coronoides comprende un tercio de la
longitud de la mandíbula de la articulación mandibular (fig. 3), que es
incompatible con la posición esperada para un bocado fuerte sostenido. La
región articular está adaptada para propalinía, y no proporcionaría un fuerte
anclaje para una mordedura aplastante. Por otra parte, la mandíbula es larga y
estrecha, mientras que la mayoría de los animales durófagos desarrollan
mandíbulas que son profundas y cortas. Una comparación con dos tortugas
marinas, Caretta caretta (Caguama
tortuga de mar), y Lepidochelys kempii
(Ridley tortugas marinas lora), ambas aplastan la mayor parte de su dieta, lo
que revela algunas diferencias. Las superficies linguales de los dentarios de Caretta caretta y Lepidochelys kempii son planas y sin adornos, con un pequeño
tubérculo en cada dentario (Jones et al. 2012). Esto es probablemente la
superficie utilizada para la trituración de moluscos y otros invertebrados, ya
que proporciona una plataforma robusta contra el que una cáscara se puede
anclar. Chirostenotes
en su lugar tiene un surco en la línea media, crestas linguales, y los surcos
oclusales laterales, y ninguna superficie plana para la trituración (fig. 2a).
Otra diferencia es la robustez relativa de las mandíbulas. Las mandíbulas de
tortuga son robustas estructuralmente, son cortas y tienen procesos coronoides
altos para las inserciones musculares (Fig. 6C). La región articular de la
mandíbula es cóncava, y cierra la mandíbula firmemente en su lugar. La
mandíbula alcanza su anchura máxima en las articulaciones, y es sólo
ligeramente más larga que ancha. No hay ventana mandibular externa, y por lo
tanto la mandíbula es una sola unidad, sólida (Fig. 6c). Caretta caretta tiene algunas pequeñas cavidades en la región de la
sínfisis,
pero Lepidochelys kempii tiene una sínfisis
sólida, en oposición a la región de la sínfisis
neumatizada de Chirostenotes (fig. 4). La
disimilitud entre las mandíbulas de Chirostenotes y
tortugas marinas sugiere que sus dietas son diferentes también. Por el
contrario, la tortuga mordedora, Chelydra
serpentina, tiene una mandíbula que es más similar a Chirostenotes.
La eminencia coronoides del Chelydra
serpentina se reduce en comparación con las dos tortugas de mar, y en
general la mandíbula es más larga y más baja. El borde oclusal del dentario es
fuerte y creció muy por encima del nivel de la sínfisis,
como en Chirostenotes.
Por otra parte, los proyectos de márgenes oclusales anteriormente a la línea
media de la mandíbula, recuerdan a Chirostenotes
(Fig. 3). La mandíbula de Chelydra se
utiliza a veces para desgarrar y rasgar, y la mandíbula de Chirostenotes
parece compatible con este comportamiento.
La digestión de la materia vegetal puede ser un
problema para algunos animales. Herbívoros especializados suelen tener algún
tipo de mecanismo que descompone la materia vegetal antes de llegar a los
intestinos donde es degradado por microorganismos simbióticos. En los mamíferos
rumiantes existentes, esto se hace por la regurgitación de bolo alimenticio, y
el reprocesamiento con los dientes. En hadrosaurios
y ceratópsidos, las baterías de los dientes eran suficientes para descomponer
la materia vegetal antes de llegar al estómago. En los saurópodos y muchas
aves, tienen gastrolitos en el estómago o molleja que descomponen la materia
vegetal mediante un proceso mecánico, en lugar de dientes. La presencia de
gastrolitos en el basal oviraptorosaur
Caudipteryx (Ji et al. 1998) sugiere que podrían haber estado presentes en
muchos Chirostenotes
derivados. Kobayashi et al. (1999) compararon los gastrolitos de ornitomímidos
y aves, y encontraron que ornitomímidos
eran más similares a las aves herbívoras a este respecto. En combinación con la
desdentada mandíbula y débil musculatura del aductor, concluyeron que ornitomímidos
eran herbívoros que utilizan gastrolitos para procesar las plantas. Aunque es
sólo una especulación, si Oviraptorosauria
poseían gastrolitos como ornitomímidos,
es razonable que fueran capaces del procesamiento de plantas. Dado que hasta
gastrolitos se encuentran en asociación con un Caenagnathidae, sin embargo, no puede suponerse que se
procesen las plantas con molleja como en el compartimiento en el sistema
digestivo.
Conclusión:
Los resultados sugieren que la mandíbula de Chirostenotes
se adaptó para la alimentación de plantas. Las crestas linguales y ranuras
laterales oclusales habrían sido eficientes en la esquila de follaje, así como
la carne, y la presencia de gastrolitos en Caudipteryx
apoya tentativamente la posibilidad de herbivoría. La carne no puede ser
excluida como una parte de la dieta, debido a que las adaptaciones para cortar
también benefician a carnívoros. Esto parece razonable, porque la mayoría de
los herbívoros en ocasiones toman proteínas animales. La falta de una amplia
kinesis en la mandíbula habría limitado el tamaño de la presa, pero la
morfología del pico que recuerda a Chelydra
sugiere que Chirostenotes
podrían haber desgarrado carne de restos grandes o matado y comido animales
pequeños. Un método de alimentación basado únicamente en la trituración parece
poco probable, pero era posiblemente una parte menor de la dieta. Chirostenotes
parece muy capaz de triturar los alimentos frágiles como huevos, pero los
alimentos más duros, como los moluscos, era probable que estuviera fuera de sus
posibilidades. Es más probable para Chirostenotes
una dieta omnívora, basada en la esquila y adaptaciones de la mandíbula, lo que
habría sido eficiente en el procesamiento de carne y plantas.
Referencias:
1.
Artículos
publicados en revistas:
·
Angielczyk,
K.D. 2004. Phylogenetic evidence for and implications of a dual
origin of propaliny in anomodont therapsids (Synapsida). Paleobiology,
30: 268–296.
·
Cracraft,
J. 1971. Caenagnathiformes: Cretaceous birds convergent in jaw mechanism to
dicynodont reptiles. Journal of
Paleontology, 45(5):
805–809.
·
Crompton,
A.W. & Hotton, N. III. 1967. Functional morphology of the masticatory
apparatus of two dicynodonts (Reptilia, Therapsida). Postilla, 109: 1–51.
·
Currie,
P.J. 1989. The first records of Elmisaurus (Saurischia,
Theropoda) from North America. Canadian Journal of Earth
Sciences, 26(6): 1319–1324.
·
Currie,
P.J. & Russell, D.A. 1988. Osteology and relationships of Chirostenotes
pergracilis (Saurischia, Theropoda) from the Judith River (Oldman)
Formation of Alberta, Canada. Canadian
Journal of Earth Sciences, 25(7):
972–986.
·
Currie,
P.J., Godfrey, S.J. & Nessov, L. 1993. New caenagnathid (Dinosauria: Theropoda) specimens
from the Upper Cretaceous of North America and Asia. Canadian
Journal of Earth Sciences, 30(10):
2255–2272.
·
Eberth,
D.A. 1990. Stratigraphy and sedimentology of vertebrate
microfossil sites in the uppermost Judith River Formation (Campanian), Dinosaur
Provincial Park, Alberta, Canada. Palaeogeography,
Palaeoclimatology, Palaeoecology 78: 1–36.
·
Gilmore,
C.W. 1924. Contributions of vertebrate palaeontology. Geological Survey of Canada, Bulletin, 38: 1–89.
·
Huene,
F.V. 1914. The dinosaurs not a natural order. American
Journal of Science (Series 4), 38:
145–146.
·
Ji,
Q., Currie, P.J., Norell, M.A. & Ji, S.A. 1998. Two feathered dinosaurs from northeastern China. Nature, 393: 753–761.
·
Jones,
M.E.H., Werneburg, I., Curtis, N., Penrose, R., O’Higgins, P., Fagan, M.J.
& Evans, S.E. 2012. The head and neck anatomy of sea turtles (Cryptodira:
Chelonioidea) and skull shape in Testudines. PLOS ONE, 7(11): e47852.
·
King,
G.M., Oelofsen, B.W. & Rubidge, B.S. 1989. The evolution of the dicynodont feeding system. Zoological
Journal of the Linnean Society, 96:
185–211.
·
Kobayashi,
Y., Lu, J.-C., Dong, Z.-M., Barsbold, R., Azuma, Y. & Tomida, Y. 1999. Herbivorous diet in an ornithomimid dinosaur. Nature, 402: 480–481.
·
Longrich,
N.R., Currie, P.J. & Dong, Z.-M. 2010. A new oviraptorid (Dinosauria: Theropoda) from the
Upper Cretaceous of Bayan Mandahu, Inner Mongolia. Palaeontology,
53: 945–960
·
Longrich,
N.R., Barnes, K., Clark, S. & Millar, L. 2013. Caenagnathidae from the Upper Campanian Aguja
Formation of West Texas, and a revision of the Caenagnathinae. Bulletin of the
Peabody Museum of Natural History, 54:
23–49.
·
Lü,
J.-C., Currie, P.J., Xu, L., Zhang, X., Pu, H. & Jia, S. 2013. Chicken-sized oviraptorid dinosaurs from Central China
and their ontogenetic implications. Naturwissenschaften,
100: 165–175.
·
Marsh,
O.C. 1881. Classification of the Dinosauria. American Journal of Science, 23: 81–86.
·
Osmólska,
H. 1976. New light on the skull anatomy and systematic position
of Oviraptor.
Nature, 262: 683–684.
·
Ray,
S. & Chinsamy, A. 2003. Functional aspects of the postcranial anatomy of the
Permian dicynodont Diictodon and their ecological implications. Palaeontology,
46: 151–183.
·
Smith,
K.K. 1988. Form and function of the tongue in agamid lizards with
comments on its phylogenetic significance. Journal of
Morphology, 196: 157–171.
·
Sternberg,
C.M. 1932. Two new theropod dinosaurs from the Belly River Formation of
Alberta. Canadian Field Naturalist, 46: 99–105.
·
Sternberg,
C.M. 1934. Notes on certain recently described dinosaurs. Canadian Field Naturalist, 48:
7–8.
·
Sternberg,
R.M. 1940. A toothless bird from the Cretaceous of Alberta. Journal of Paleontology, 14(1): 81–85.
·
Sues,
H.-D. 1997. On Chirostenotes, a Late Cretaceous
Oviraptorosaur (Dinosauria: Theropoda) from western North America. Journal of
Vertebrate Paleontology, 17(4):
698–716.
2.
Artículos:
·
Barsbold,
R. 1976. [On a new Late Cretaceous family of small theropods (Oviraptoridae
fam. n.) of Mongolia.] Transactions of the Joint Soviet-Mongolian Geological
Expedition, Vol. 3, pp. 68–75. [In Russian.]
·
Barsbold,
R. 1977. [Kinetics and peculiarity of the jaw apparatus of Oviraptors
(Theropoda, Saurischia).] Transactions of the Joint Soviet-Mongolian Geological
Expedition, Vol. 4, pp. 37–47. [In Russian.]
·
Barsbold,
R. 1983. [Carnivorous dinosaurs from the Cretaceous of Mongolia.] Transactions
of the Joint Soviet-Mongolian Paleontological Expedition, Vol. 19, pp. 5–120.
[In Russian.]
·
Cluver,
M.A. 1971. The cranial morphology of the dicynodont genus Lystrosaurus.
Annals of the South African Museum, 56(5):
155–273.
·
Currie,
P.J. 2005. Theropods, including birds. In Dinosaur Provincial Park: a
spectacular ancient ecosystem revealed. Edited by P.J. Currie and E.B.
Koppelhus. Indiana University Press, Bloomington, Ind. pp. 367–397.
·
Gauthier,
J. 1986. Saurischian monophyly and the origin of birds. In The origin of
birds and the evolution of flight. Edited by K. Padian. California
Academy of Sciences, San Francisco. pp. 1–55. [Memoirs of the California
Academy of Sciences 8.]
·
Hotton,
N., III. 1986. Dicynodonts and their role as primary consumers. In The
ecology and biology of mammal-like reptiles. Edited by N. Hotton, III., MacLean,
P.D., Roth, J.J. & Roth, E.C. Smithsonian Institution Press, Washington,
D.C., pp. 71–82.
·
Osborn,
H.F. 1924. Three new Theropoda, Protoceratops Zone, Central Mongolia. American
Museum Novitates, 144: 1–12.
·
Owen,
R. 1842. Report on British fossil reptiles. Part II. Report of the British
Association for the Advancement of Science, 11: 60–204.
·
Parks,
W.A. 1933. New species of dinosaurs and turtles from the Upper Cretaceous
formations of Alberta. University of Toronto Studies, Geological Series, 34: 1–33.
·
Seeley,
H.G. 1888. On the classification of the fossil animals commonly named
Dinosauria. Proceedings of the Royal Society of London, 43: 165–171.
·
Sullivan, C. & Reisz, R.R. 2005. Cranial anatomy and taxonomy of the Late Permian
dicynodont Diictodon.
Annals of Carnegie Museum, 74:
45–75.
·
Sullivan,
C., Reisz, R.R. & Smith, R.M.H. 2003. The Permian mammal-like herbivore Diictodon,
the oldest known example of sexually dimorphic armament. Proceedings of the Royal Society B: Biological
Sciences, 270: 173–178.
·
Zanno,
L.E. & Makovicky, P.J. 2011. Herbivorous ecomorphology and specialization patterns in theropod
dinosaur evolution.
Proceedings of the National Academy of Sciences of the United States of
America, 108: 232–237.





No hay comentarios:
Publicar un comentario