Como vimos en la
anterior publicación, los grandes herbívoros
tienen una gran capacidad de alterar los ecosistemas que habitan, pero esto
puede ser problemático cuando las poblaciones son altas.
Volvemos al Pleistoceno, donde la diversidad de megaherbívoros era tal que, de no ser
limitadas sus poblaciones de alguna manera, se hubiese producido una degradación de su ecosistema, pero grandes carnívoros (21.5–99 kg) y megacarnívoros (≥100 kg) ejercerían el control de las poblaciones de megaherbívoros y, consecuentemente, mantendrían el equilibrio del ecosistema.
Artículo principal: Van Valkenburgh B., Hayward M.W., Ripple W.J., Meloro C., Roth V.L. (2016) The impact of large terrestrial carnivores on Pleistocene ecosystems. Proceedings of the National Academy of Sciences of United States of America, 113: 862–867.
COMPAREMOS:
La importancia de los
carnívoros en la modificación de los ecosistemas terrestres es considerablemente
subestimada porque su diversidad y tamaño corporal son mucho más reducidos en
la actualidad que en el pasado.
 |
| Gráfico 1: relaciones de masa corporal. |
En el gráfico 1 podemos ver que en
general, en el Pleistoceno había
más especies con masas mayores de 100 kg (en rojo) las cuales eran especies con habilidades y medios
para cazar presas de gran tamaño y en general mas grandes y robustas que las actuales (en azul).
Examinando
comunidades de mamíferos se encontró que a medida que aumenta el número de
megaherbívoros aumenta también la probabilidad de encontrar en su entorno tres
o más hipercarnívoros. De hecho, en
las cuatro comunidades fósiles del Pleistoceno
que se examinaron se encontró que había de dos a seis megaherbívoros y de cuatro a siete hipercarnívoros.
Una de las hipótesis
que explica esta correlación es que la presencia de grandes herbívoros promueve
(o permite, al menos) la coexistencia entre grandes depredadores. Dado su
tamaño, los grandes herbívoros proporcionan recursos suficientes para bastantes
depredadores, pero también es posible que los propios herbívoros modifiquen su
entorno hacia condiciones más propicias para el éxito de la caza de los
carnívoros (bien porque puedan esconderse en arbustos, bien porque el terreno les
facilite la carrera).
En el Viejo Mundo,
los megaherbívoros por lo general incluyen mamuts (Mammuthus sp.), rinocerontes (Stephanorhinus sp., Coelodonta sp.) y bóvidos (Praeovibos sp., Bison sp.) (Palmqvist et al. 1996) En
América del Norte, la riqueza de especies de megaherbívoros fue aún mayor. En
el Rancho La Brea, California, se han encontrado seis megaherbívoros del Pleistoceno
tardío: proboscídeos (Mammuthus columbi y Mammut americanum),
camello gigante (Camelops hesternus), bisonte (Bison antiquus)
y perezosos terrestres (Megalonyx jeffersonii y Paramylodon harlani) (Stock & Harris. 1992).
Algunos de los
hipercarnívoros del Pleistoceno fueron: felinos dientes de sable (Smilodon sp., Homotherium sp.), además parientes mucho más
grandes de león actual (Panthera leo spelaea y
Panthera leo atrox)
tanto en el Antiguo como en el Nuevo Mundo, así como la hiena de las cavernas (Crocuta crocuta spelaea)
en el Viejo Mundo y un enorme oso (Arctodus simus) en el Nuevo Mundo.
El tamaño de cuerpo
de las presas tiende a crecer con el tamaño del depredador (Sinclair et al. 2003) y, dada la prevalencia de
grandes carnívoros en relación con los megaherbívoros, es de suponer que la
presión de depredación sobre los herbívoros era mayor entonces que en la
actualidad. No obstante, se sabe que ni siquiera los mayores carnívoros
atacaban con frecuencia elefantes, hipopótamos o rinocerontes adultos.
Cazadores solitarios... ¿¿O SOCIALES TAL VEZ??
El comportamiento de
las especies de depredadores que existen hoy en día sugiere que las condiciones
en el Pleistoceno habrían favorecido
la socialización y la existencia de
manadas muy numerosas. Más allá de permitir el ataque a presas de mayor tamaño,
trabajar en grupo permite a la mayoría de depredadores defender a sus presas
una vez cazadas de posibles “ladrones de presas”; de hecho, en enfrentamientos
observados entre hienas y leones, por ejemplo, salía victorioso el grupo más
numeroso.
Dado el número de
factores antrópicos que limitan la abundancia de grandes carnívoros (como la pérdida
del hábitat, competencia por las presas ó persecución directa) es más probable
que la densidad de depredadores y el tamaño de los grupos fuera
considerablemente mayor en el Pleistoceno (Ripple et al. 2014). Si esto fuera así, la competencia por las
presas ya cazadas habría sido mucho más frecuente y el tamaño del grupo habría
sido un factor determinante en la pervivencia de las manadas.
De acuerdo con su
morfología y sus parientes actuales, algunos de los grandes hipercarnívoros del Pleistoceno como el lobo gigante (Canis dirus), lobo gris (Canis lupus) y la
hiena de las cavernas ( Crocuta crocuta spelaea)
fueron sociales por necesidad, ya que no podían abordar una presa grande
individualmente. Este hecho junto a que el éxito de la caza aumenta con el
número de atacantes permite suponer que, al menos por etapas, algunos o todos
los grandes felinos del Pleistoceno fueron sociales. Sin embargo, hay argumentos en favor de la
sociabilidad de estos (Carbone et al. 2009) pero también los
hay en contra (McCall et al. 2003).
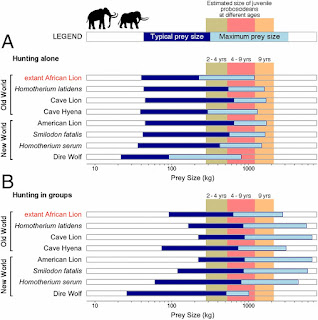 |
| Gráfico 2: tamaños de las potenciales presas. |
En el gráfico 2 se comparan los tamaños de las
posibles presas que serian capaces de cazar varias de las especies del Pleistoceno con las que es capaz de cazar el león actual. Estas observaciones se han hecho tanto para la caza de forma individual (A) como en grupo (B).
También queda reflejado el tamaño de los proboscídeos según su edad en las columnas de colores.
¿Como afectaban al ecosistema?
Más allá de la capacidad
de los hipercarnívoros para cazar
megaherbívoros de manera habitual, lo realmente importante para la evolución de
los ecosistemas es si los carnívoros eran capaces mediante la caza de limitar
las poblaciones de herbívoros (Ripple & Van Valkenburgh. 2010). La opinión generalizada es que “antes
de la llegada del ser humano, las poblaciones de mamuts, mastodontes y otros
megaherbívoros habrían existido a niveles de saturación donde el número de
individuos estaba limitado por la presencia de alimento para todos ellos” (Owen-Smith. 1988).
Probablemente, la
caza selectiva de individuos juveniles de estas poblaciones habría
intensificado el efecto de los hipercarnívoros
sobre ellas, ya que se trata de especies con una tasa de reproducción
generalmente baja y, por tanto, muy susceptibles a la presión de depredación. En casos extremos, la falta de individuos
jóvenes habría conducido irremediablemente a la extinción de la especie (Johnson. 2002) mientras que en especies con una tasa de
reproducción alta el efecto no hubiese sido tan devastador.
Algunos modelos
teóricos sostienen la idea de que las poblaciones de herbívoros de medio y gran
tamaño habrían estado limitadas por la actividad de los hipercarnívoros del Pleistoceno (Meloro & Clauss. 2012) pero la teoría es menos clara a la hora de
aplicarse a megaherbívoros. Basándose
en estudios sobre el elefante africano, no está del todo claro si la propia
especie puede autorregularse y mantener de forma autónoma un número estable de
individuos sanos (Gough & Kerley. 2006).
Lo más probable es
que los hipercarnívoros hayan
limitado las poblaciones de algunos megaherbívoros
mediante su depredación continua (Ripple & Van Valkenburgh. 2010), pero que haya sido solamente
uno de muchos factores concurrentes. Sequías periódicas pueden afectar de
manera muy severa a las poblaciones de elefantes o de rinocerontes,
especialmente a individuos jóvenes o preadultos.
En el caso de los
humanos el impacto de su aparición sobre los megaherbívoros (Barnosky et al. 2004) se habría visto fuertemente incrementado sobre especies que ya sufrían una
presión de depredación cercana a su límite soportable y habría estado apoyada
por episodios de incendios, sequías u otras situaciones extremas.
Al tratar con comundidades extintas es muy difícil averiguar ciertos comportamientos (algunos de ellos tan básicos como la socialización de estas especies), los cuales podemos tratar de inferir a través de los comportamientos de las especies actuales.
Muy probablemente los carnívoros mantuvieron el débil equilibrio de un ecosistema que una vez llegado el ser humano no pudo recuperarse, por lo que una vez mas deberíamos atender a las valiosas pistas que nos ha dejado el pasado para de este modo llevar a cabo una conservación eficaz de la fauna actual y así proteger los procesos ecológicos que tienen lugar entre los grandes mamíferos actuales.
BIBLIOGRAFÍA.
- Barnosky A.D., Koch P.L., Feranec R.S., Wing S.L., Shabel A.B. (2004) Assessing the causes of late Pleistocene extinctions on thecontinents. Science 306(5693):70–75.
- Carbone C., Maddox T., Funston P.J., Mills M.G.L., Grether G.F., Van Valkenburgh B. (2009) Parallels between playbacks and Pleistocene tar seeps suggest sociality in an extinct sabretooth cat, Smilodon. Biology Letters 5(1):81–85.
- Gough K.F., Kerley G.I.H. (2006) Demography and population dynamics in the elephants Loxodontaafricana of Addo Elephant National Park, South Africa: Is thereevidence of density dependent regulation?. Oryx 40(4):434–441.
- Van Valkenburgh B., Hayward M.W., Ripple W.J., Meloro C., Roth V.L. (2016) The impact of large terrestrial carnivores on Pleistocene ecosystems. Proceedings of the National Academy of Sciences of United States of America, 113: 862–867.
- Johnson C.N. (2002) Determinants ofloss of mammal species during the Late Quaternary ‘megafauna’ extinctions: Lifehistory and ecology, but not body size. Proceedings of the Royal Society B: Biological Sciences 269(1506):2221–2227.
- McCall S., Naples V., Martin L. (2003) Assessing behavior in extinct animals: Was Smilodon social? Brain Behavior and Evolution 61(3):159–164.
- Meloro C., Clauss M. (2012) Predator-prey biomass fluctuations in the Plio-Pleistocene. Palaios 27:90–96.
- Owen-Smith RN. (1988) Megaherbivores:The Influence of Very Large Body Size on Ecology (Cambridge Univ Press, Cambridge, UK).
- Palmqvist P., Martinez-Navarro B., Arribas A. (1996) Prey selection by terrestrial carnivores in a lower Pleistocenepaleocommunity. Paleobiology 22:514–534.
- Ripple W.J., Estes J.A., Beschta R.L., Wilmers C. C., Ritchie E.G., Hebblewhite M., Berger J., Elmhagen B., Letnic M., Nelson M.P., Schmitz O.J., Smith D.W., Wallach A.D., Wirsing A.J. (2014) Status andecological effects of the world’s largest carnivores. Science, 343(6167):1241484.
- Ripple W.J., Van Valkenburgh B. (2010) Linking top-down forces to the Pleistocenemegafaunal extinctions. Bioscience 60(7):516–526.
- Sinclair A.R., Mduma S., Brashares J.S. (2003) Patterns of predation in a diverse predator-prey system. Nature, 425(6955):288–290.
- Stock C., Harris J.M. (1992) Rancho La Brea, a record of Pleistocene life in California. Natural History Museum of Los Angeles County Science Series No. 37 Natural History Museum of Los Angeles, Los Angeles.

1 comentario:
Algunas reseñas de la prensa:
https://www.sciencedaily.com/releases/2015/10/151026171412.htm
http://www.sci-news.com/paleontology/science-pleistocene-hyper-carnivores-03379.html
Publicar un comentario